Междинна сума: 170,00 лв.
ПРОБИОТИЦИ И ТЕХНИТЕ ПРИЛОЖЕНИЯ – първа част!
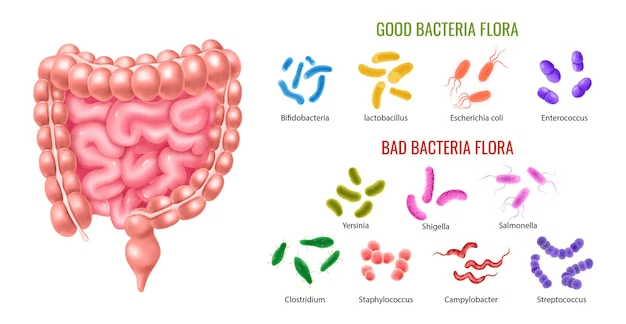
1.Помагат ли пробиотиците при атопичен дерматит?
Атопичният дерматит е често срещано кожно заболяване, при което кожата става суха, раздразнителна и се зачервява. Някои пациенти с подобни оплаквания използват пробиотици, за да контролират състоянието си.
Проучвания съобщават, че 31.6 млн. души в САЩ имат атопичен дерматит. Това заболяване засяга най-вече деца.Този проблем се превръща в ежедневна борба. Около 1/3 от заболелите споделят, че дневно отделят от 1 до 3 часа за грижи срещу дерматита. Възможно ли е пробиотиците да са отговорът?Атопичният дерматит се отразява върху качеството на живота. В по-острите случаи на заболяването се появява кървене и загрубяване на кожата. Поради тази причина, пациентите винаги търсят нови начини за борба със симптомите на болестта. Някои привърженици на здравословното хранене прибягват до пробиотиците като начин за лечение.
Бързи факти за пробиотиците при атопичен дерматит:
Атопичният дерматит е реакция на имунната система и поради този факт, пробиотиците могат да помогнат.
- Пробиотиците имат допълнителни положителни ефекти като подобряване на храносмилането.
- Въпреки че съществуват много обещаващи проучвания на тази тема, все още не е установено действието на пробиотиците при дерматит.
- https://deusspharm.bg/product/%d0%bf%d1%80%d0%be%d0%b1%d0%b8%d0%be%d1%82%d0%b8%d0%ba-%d0%bf%d1%80%d0%b5%d0%b1%d0%b8%d0%be%d1%82%d0%b8%d0%ba-%d0%b8-%d0%bf%d0%be%d1%81%d1%82%d0%b1%d0%b8%d0%be%d1%82%d0%b8%d0%ba-%d0%be%d1%82-%d1%84/Съчетаното лечение, включващо пробиотици с други медикаменти, е оптимално за болестта.
Защо да използваме пробиотици при атопичен дерматит?
Има различни видове дерматит, но най-често срещаният тип е атопичният. Имайки предвид какви фактори предизвикват този вид заболяване, може да се разбере защо пробиотиците помагат с лечението му.Атопичният дерматит може да се провокира от фактори на околната среда, но това не е причината за появата му. Причината е неправилна реакция на имунната система, предизвиквайки възпаление, сухота и сбръчкване на кожата. Поради това учени са установили, че лечението е свързано с подсилване на имунитета. Тук се включват в действие пробиотиците.
Здравословна бактерия и пробиотици
Състоянието на микробиома в стомашно-чревният тракт е основен фактор, влияещ на имунната система. Поради тази причина много хора посягат към пробиотиците, вярвайки че те повишават количеството на полезни бактерии в ГИТ.Доказано е, че пробиотиците, давани в детска възраст, помагат за превенцията на развитие на дерматит. Проучване от 2010 г. твърди, че децата с атопичен дерматит имат по-различна стомашна флора от здрави деца. Това откритие подкрепя идеята, че приемането на средства за подобряване на микробиома се отразява положително.Същото проучване открива леко клинично подобрение в състоянието при използването на пробиотици. Въпреки това, тези открития не са били достатъчно ясни, за да се каже със сигурност, че пробиотиците са ефективен метод за лечение.Проучване от 2016 г. отбелязва, че пробиотиците имат положителен ефект при борбата с атопичния дерматит. Тези ползи зависят от:
- Специфичността на използваните пробиотици.
- Начинът на приемане.
- Продължителността на приемане.
- Дозирането.
Това изследване подчертава, че все още има недостатъчно доказателства за ефективността на пробиотиците при борбата с дерматита. Уповавайки се на съществуващите клинични тестове, медицинските лица не могат да кажат със сигурност дали пробиотиците помагат. Нужни са допълнителни проучвания по въпроса.
Други методи за лечение:
- Хидратиращи кремове.
- Кортикостероидни кремове, намаляващи хиперемията и отока.
- Антихистаминни, намаляващи сърбежа.
- Пластири, подпомагащи възстановяването на възпалената зона.
- Дрехи от естествени материи.
- Поддържане на определена температура, ако високите градуси предизвикват дразнение.
- Използване на хипоалергична козметика.
- Избягване на храна, предразполагаща към обостряне на симптомите.
Как помагат пробиотиците?
Пробиотиците са живи бактерии, които подобряват храносмилателната активност на организма. Съществуват храни, които са натурално обогатени с пробиотици. Такива са например:
- Кисело мляко
- Кефир
- Кисело зеле
- Кимчи
- Черен шоколад
- Комбуча
- Мисо
- Прясно сирене
- Ябълков сайдер
Пробиотиците се намират и под формата на хранителни добавки, съдържащи Lactobacillus и Bifidobacterium.Живата бактерия в пробиотиците се залавя за лигавицата на червата, неоставяйки място за „лошите” бактерии да пролиферират. Това води до здравословен баланс на бактерии в храносмилателния тракт, подобрявайки функцията му.
Други положителни ефекти на пробиотиците
Консумирайки богати на пробиотици храни или приемайки хранителни добавки, съдържащи ги води до:
- Подобряване на храносмилането
- По-силна имунна система
- Превантира развитието на уринарни инфекции
Връзката между микрофлората и имунния отговор на организма при атопичен дерматит подкрепя идеята, че пробиотиците са ефективно лечение. Съществуват и клинични индикации, подкрепящи тази хипотеза. Въпреки това все още не е доказано, че помагат при дерматит. Важно е да се отбележи, че не трябва да се разчита на пробиотиците за третиране на болестта. Пробиотиците не вредят и може да се прилагат като допълнителен медикамент. По този начин ще се подсили храносмилането и имунитета.
2. Пробиотици при акне!
Акнето е едно от най-често срещаните, объркващи, разочароващи и мистериозни кожни състояния. Това, което работи при хормонални пъпки, не е най-доброто решение за случайните червени гневни подутини, поради което консултацията с дерматолог е от първостепенно значение. „Пробиотиците са съставки, които насърчават растежа на здрави бактерии в телата ни“, обяснява Zeichner. Пробиотиците успокояват възпалението. Приемът им е полезен за поддържане на лигавицата на храносмилателния тракт гладка и здрава. Теорията зад употребата на пробиотици за акне е, че те могат да нормализират баланса на „полезните“ бактерии върху кожата и да намалят възпалението. Пробиотиците инхибират производството на Propionibacterium acnes. „Подобно на начина, по който действат антибиотиците при лечението на акне и розацея, пробиотиците могат да помогнат в борбата с възпалението от самото начало.“ Пробиотиците освен това възстановяват естествената бариера на кожата и я предпазват от влага и раздразнения. Пробиотичната грижа за кожата няма забележими странични ефекти. „Пробиотиците могат да се приемат през устата като ефективен, но индиректен начин за лечение на акне“, обяснява Zeichner. „В ситуации, в които микробиомът е променен, пациентът може да развие възпаление в храносмилателния си тракт, което да се разпространи в общото кръвообращение и в кожата. Локалните продукти за грижа за кожата обикновено не съдържат живи микроорганизми. Повечето съдържат пребиотици, които по същество са храни, които преференциално поддържат растежа на здравите бактерии върху кожата.“
3.Пробиотиците при алергични състояния!
Микробиомът представлява съвкупност от бактерии, гъбички и вируси, които живеят във и върху тялото, и може да се счита за компонент на вродената имунна система, тъй като влияе върху механизмите на защита на организма.
Микробният състав пряко влияе върху имунния отговор и неговата ефективност, предпазва от свръхрастеж на патогени и модулира баланса между възпалението и имунната хомеостаза. Например микробите върху кожата взаимодействат с имунната система и насърчат заздравяването на раните. Непатогенните коагулазоотрицателни стафилококи върху кожата произвеждат антимикробен пептид, който може да инхибира растежа на патогенния Staphylococcus aureus. Тези защитни щамове са дефицитни при атопичен дерматит. Оралната микробиота може да образува симбиотични биофилми, които балансират нивата на pH и потискат растежа на патогените в устата. Вече има убедителни данни, че чревният микробиом влияе и върху нервната система.
Терминът “дисбиоза” се дефинира като промяна в състава, разнообразието или метаболитите на микробиома, изразяващо се в нарушаване на чревната хомеостаза и предразположение към различни заболявания. Употребата на антибиотици е най-честата причина за това. Смята се, че дисбиозата играе роля при затлъстяването, диабет тип 2, коронарна артериална болест, хранителна алергия, астма и атопичен дерматит. Поради ролята си на оркестратор на биологични процеси, микробиомът е мишена за терапевтични интервенции. Въздействието върху чревния микробиом чрез промяна на диетата се използва с известен успех за лечение на диабет тип 2, рефрактерен на имунотерапия меланом, а полученият от микробиома метаболит (триметиламин N-оксид – TMAO) насърчава имунната активация при рак на панкреаса. Има все повече доказателства, че смущенията в чревния микробен състав играят роля в патофизиологията на имуномедиирани нарушения, като алергичните заболявания например. Чревната микробиота е ключов играч в ранното развитие както на локалното имунно съзряване, така и на системното имунно програмиране.
Разпространението на алергичния ринит, астмата и хранителните алергии бележи забележително увеличение през последните десетилетия. Най-вероятно промените в околната среда имат важно значение за тази алергична епидемия, но останалите фактори не са напълно идентифицирани. Според хигиенната хипотеза намаляването на общата микробна експозиция през ранното детство, със съответните промени в коменсалната микробиота, играе важна роля. Нормалната имунна хомеостаза зависи от чревната микробиота и може да бъде повлияна от разликите в моделите на колонизация. Епидемиологичните асоциации между намаляващата експозиция на микроби и алергичните заболявания се подкрепят от редица проучвания с животински модели, демонстриращи, че ранното излагане на патогенни или непатогенни микробни продукти може или да предотврати, или да промени алергичните реакции.
Чревната микробиота предоставя специфични имунопротективни ефекти, които вероятно се медиират чрез сложни пътища в свързаната с червата лимфоидна тъкан (GALT), която е най-големият имунен „орган“ при хората. Тези ефекти включват променено локално производство на имуноглобулин А (IgA) и индуциране на толерогенни дендритни клетки и регулаторни Т-клетъчни популации, с производство на имуномодулаторни цитокини, като интерлевкин (IL) 10 и трансформиращ растежен фактор (TGF) бета. Тези механизми колективно инхибират локалното възпаление, подобряват механизмите на чревната бариера и следователно намаляват риска от неподходящи системни имунни отговори. През първите месеци от живота има огромна промяна от “стерилната” среда в утробата към микробна колонизация с повече от 1014 организма, превъзхождащи общия брой човешки клетки с повече от 10:1. През същия период функционално незрялата неонатална имунна система също трябва да се развие, за да постигне сложен и фино настроен баланс между защитата на гостоприемника и имунната толерантност. Проучвания при животни без микроби показват, че оралната толерантност не може да бъде предизвикана при липса на чревна микробиота. Въпреки че пълната имунна функция и оралната толерантност могат да бъдат възстановени чрез въвеждане на нормална чревна микробиота, това зависи от възрастта и не може да се постигне при зрели животни.
Тези наблюдения подчертават съществената роля на чревната микробиота в развитието на имунната система и илюстрират значението на времето на първоначалната колонизация. Редица проучвания при хора показват разлики в ранните модели на колонизация на бебета, които развиват алергично заболяване. Проучвания съобщават, че ниските нива на бифидобактерии и ранната колонизация с потенциално патогенни бактерии, като Clostridioides difficile и Staphylococcus aureus, са по-разпространени при деца, които впоследствие са развили алергия. Следователно се предполага, че високото чревно микробно разнообразие може да бъде по-важно от отсъствието или присъствието на специфични родове или видове в контекста на съзряването на имунната система и последващото развитие на имуномедиирани разстройства. Проспективни проучвания демонстрират, че се наблюдава намалено чревно микробно разнообразие в началото на живота при кърмачета, които по-късно развиват алергични прояви.
Рандомизирани, контролирани проучвания, оценяващи ефектите на пребиотиците за лечение на алергични заболявания, са оскъдни и са необходими допълнителни проучвания преди да могат да се направят каквито и да било заключения. Първоначалните мета-анализи не предполагат полза от пероралните пробиотици при лечението на екзема или астма. Един мета-анализ съобщава за благоприятен ефект на пробиотиците при лечението на алергичен ринит, но той не е убедителен и са необходими допълнителни проучвания. Препоръчва се повишено внимание, когато се използват пробиотици при имунокомпрометирани пациенти, включително недоносени бебета, поради повишен риск от неблагоприятни ефекти и в редки случаи инфекция, причинена от гъбично замърсяване. Има редица мета-анализи за използването на пробиотици за лечение на екзема, но повечето са стигнали до заключението, че няма последователни доказателства, че живите перорални пробиотици са полезни за лечение на установена екзема. Допълнителни анализи на подгрупи според доказателства за алергенна сенсибилизация или тежест на екзема не потвърждават това заключение.
В допълнение, високата степен на хетерогенност, която включва изразени разлики в пробиотичните препарати, изследваните популации и измерванията на резултатите, възпрепятства директното сравнение на проучванията. Lactobacillus rhamnosus GG (LGG) е най-широко проучваният щам до момента при лечението на атопичен дерматит както с положителни, така и с отрицателни резултати. Три други пробиотични щама (Lactobacillus fermentum VR1-003PCC, Lactobacillus sakei KCTC 10755BP и Lactobacillus plantarum CJLP133) също показват умерени положителни резултати. Предварителните данни показват, че мъртвите пробиотични микроорганизми, приложени орално или локално, могат да бъдат ефективни при лечението на екзема, но са необходими допълнителни проучвания. Ефектът на пробиотиците при лечението на алергични заболявания е проучен за първи път при бебета с екзема, със или без свързана хранителна алергия. В едно ранно проучване бебета, хранени с eHF с добавен LGG или Bifidobacterium lactis, имат по-бързо подобрение на екземата в сравнение с плацебо (само eHF). За разлика от това, няма ефект от приложението на LGG върху екзема в проучване със сравним дизайн.https://deusspharm.bg/product/%d0%bf%d1%80%d0%be%d0%b1%d0%b8%d0%be%d1%82%d0%b8%d0%ba-%d0%b8%d0%bd%d1%83%d0%bb%d0%b8%d0%bd-4-%d0%bc%d0%b8%d0%bb%d0%b8%d0%b0%d1%80%d0%b4%d0%b0-%d0%b6%d0%b8%d0%b2%d0%b8-%d0%bf%d1%80%d0%be%d0%b1/
Резултатите от по-голямо проучване предполагат, че чувствителните към имуноглобулин Е (IgE) индивиди може да са по-склонни да се възползват от пробиотично лечение. Дефиницията за пробиотици показва, че микроорганизмите трябва да са живи, за да проявят своите ефекти. Въпреки това има някои доказателства, че мъртвите пробиотични микроорганизми също могат да окажат благоприятен ефект. В едно проучване 60 деца (на възраст от 1 до 12 години) с екзема са рандомизирани на инактивиран с топлина Lactobacillus acidophilus L-92 или плацебо в продължение на осем седмици. И двете групи показват подобрение в тежестта на екземата (както е оценено чрез индекса на зоната и тежестта на атопичния дерматит), но подобрението е по-голямо в групата, назначена на L. acidophilus L-92. В проучване на 50 участници на възраст >16 години с атопичен дерматит, приемът на убит от топлина L. acidophilus L-92 довел до намалена тежест на екземата, използвайки както обективни, така и субективни оценки в сравнение с плацебо групата. Много по-ранно проучване също е предназначено да сравни ефекта на жизнеспособен или топлинно инактивиран LGG с плацебо при лечението на екзема и алергия към краве мляко.
Въпреки това изпитването е преждевременно прекратено поради неблагоприятни ефекти (стомашно-чревни симптоми) в групата на кърмачетата, които са получили топлинно инактивиран LGG. Следователно не могат да се направят категорични заключения. Необходими са още изследвания, за да се установи дали инактивираните микроорганизми са ефективни при лечението на екзема. Повечето проучвания са използвали перорално поглъщане на пробиотици, но има ограничени проучвания за локално приложение. В едно рандомизирано проучване локалното приложение на лизат от Vitreoscilla filiformis (непатогенна грам-отрицателна бактерия)доведе до значително клинично подобрение и намаляване на кожната колонизация на Staphylococcus aureus в сравнение с плацебо. Тези предварителни резултати се нуждаят от допълнително валидиране.
Повечето проучвания, използващи пробиотици при лечението на респираторни алергични заболявания, са оценили ефектите на пробиотиците при лечението на алергичен ринит при юноши и възрастни с противоречиви резултати. Няколко проучвания съобщават, че някои пробиотични щамове като Bifidobacterium longum (BB536), Lactobacillus paracasei Lp33 и L. acidophilus L-92 намаляват симптомите на алергичен ринит и подобряват качеството на живот, докато има няма полза от LGG или Lactobacillus casei щам Shirota. Мета-анализи установяват, че изразената хетерогенност сред проучванията затруднява директното сравнение. Въпреки че пробиотиците могат да подобрят симптомите и качеството на живот при пациенти с алергичен ринит, доказателствата все още са ограничени поради хетерогенността в дизайна на проучването и измерванията на резултатите. Проучване, публикувано след този мета-анализ, съобщава, че пробиотична комбинация от един Lactobacillus и два щама Bifidobacterium подобрява качеството на живот при възрастни с алергичен ринит в сравнение с плацебо; въпреки това няма ефект върху концентрациите на IgE или процентите на регулаторните Т-клетки (Treg). В допълнение, проучване при 63 деца на възраст от 7 до 12 години, с потвърдена алергия към домашни акари и умерен до тежък алергичен ринит, публикувано след първия мета-анализ, показва, че левоцетиризин плюс щам на Lactobacillus johnsonii е по-добър от левоцетиризин самостоятелно за подобряване на носовия пиков експираторен дебит. Не се наблюдава полза от пробиотиците в мета-анализа на четири проучвания на пробиотици при лечението на астма. Този мета-анализ не включва впоследствие публикувано проучване, което показва ползата от Lactobacillus gasseri върху обективните измервания на дихателните пътища. Алергичният ринит често съществува едновременно с астма. Поради това няколко проучвания включват пациенти с астма и алергичен ринит. Едно рандомизирано проучване на 187 деца в предучилищна възраст с респираторни алергични заболявания (астма и/или алергичен ринит) оценява ефектите от дългосрочната консумация на ферментирало мляко с добавяне на щам L. casei в сравнение с неферментирало мляко (плацебо). Епизодите на ринит са били по-малко в пробиотичната група по време на 12-месечната интервенция, но не е имало намаляване на епизодите на астма. Въпреки това не е потвърдено дали епизодите на ринит са от алергичен или вирусен произход. Друго проучване рандомизира 118 деца на възраст от 6 до 12 години с лека до умерена персистираща астма и персистиращ алергичен ринит на ежедневен прием на L. gasseri или плацебо в продължение на осем седмици. И двете групи съобщават за намаляване на клиничната тежест на астмата и алергичния ринит след лечение, но броят на пациентите с подобрен резултат е по-висок в групата на пробиотиците. Установено е увеличение на форсирания експираторен обем за една секунда (FEV1), форсирания витален капацитет (FVC), FEV1/FVC и постбронходилататорния FEV1 след пет седмици лечение при деца, получаващи пробиотици в сравнение с плацебо, което демонстрира ефект върху обективните измервания на дихателните пътища.
Странични ефекти и безопасност
Като цяло профилът на безопасност както на пребиотиците, така и на пробиотиците е добър, с малко странични ефекти, наблюдавани в докладваните по-рано клинични проучвания. Два мета-анализа, които анализират безопасността на пребиотиците в ранна детска възраст, заключават, че формулата с добавени пребиотици се понася добре при доносени и недоносени бебета. Пребиотиците са предназначени селективно да стимулират полезната микробиота.
Въпреки това недоносените бебета може да нямат установена микробиота, която да използва пребиотици за насърчаване на здравето. Съществува поне теоретична загриженост, че субстратът може да насърчи растежа на потенциални патогени или коменсални луминални организми, които биха могли да преминат през незрялата чревна епителна бариера и да причинят системно заболяване. Животински модели демонстрират повишена бактериална транслокация в червата на незрели малки, хранени с млечна формула, съдържаща GOS и инулин. Не са наблюдавани неблагоприятни ефекти в едно рандомизирано проучване с пребиотици. Друго рандомизирано проучване с пребиотици съобщава за нормален и подобен растеж както в групата на лечение, така и в групата на плацебо. Резултатите от проучване за първична превенция, използващо комбинация от пребиотици и пробиотици, не показват разлики в страничните ефекти или растежа между деца, получаващи синбиотик спрямо плацебо до петгодишна възраст.

Приложението на пробиотици изглежда безопасна интервенция в пренаталния и постнаталния период при здрави индивиди. Най-често използваните пробиотици в профилактиката на алергиите са бифидобактериите и лактобацилите, нормални коменсали на микробиотата на бозайниците. Те са налични в различни видове храни от много години и са „общопризнати като безопасни“. Теоретично, пробиотиците могат да причинят системни инфекции, вредна метаболитна активност, прекомерна имунна стимулация и генен трансфер. Съобщава се за Lactobacillus септицемия при деца със синдром на късо черво, получаващи добавки с LGG. Освен това се препоръчва повишено внимание при използване на пробиотици при имунокомпрометирани пациенти, включително недоносени бебета, поради повишен риск от неблагоприятни ефекти и в редки случаи инфекция, причинена от гъбично замърсяване. Безопасността на пробиотиците по време на бременност е оценена в мета-анализ[10].
Приемът на лактобацили и бифидобактерии по време на бременност не оказва влияние върху честотата на цезарово сечение, теглото при раждане или гестационната възраст. Няколко проучвания за първична превенция съобщават за парадоксално увеличение на възможните резултати от алергия с пробиотици, включително сенсибилизация, бронхиална обструкция и тенденции към повече ринити и астма. Действителна причинно-следствена връзка не е потвърдена и последващи проучвания, които оценяват показателите на белодробната функция и издишвания азотен оксид (eNO) не показват вреда по отношение на лечението с пробиотици. Продуктите, използвани в клиничните изпитвания, са внимателно проверени за замърсяващи алергени. Въпреки това не е необичайно наличните в търговската мрежа пробиотици да бъдат замърсени с протеини от краве мляко. Има съобщения за сенсибилизация към замърсяващи млечни протеини и за анафилаксия към пробиотици при деца с алергия към краве мляко поради замърсяване с протеини от краве мляко. Клиницистите трябва да насърчават осъзнаването на тези рискове.
4.Вагинални пробиотици!
Точното познаване на композицията и екологията на вагиналната микробна среда на здравата жена е необходимо за разбирането на нормалната флора и начина за намаляване риска от заболявания. Влагалището и неговата микрофлора формират една балансирана екосистема, в която се намира голямо количество и разнообразие на бактерии. Най-общо те се разделят в зависимост от нуждата си от кислород на аеробни и анаеробни, а в зависимост от своята патогенност на условно-патогенни, патогенни и микроорганизми без патогенен потенциал. Лактобацилите са доминиращите бактерии във влагалището на здравите пременопаузални жени. От първото микробиологично описание на влагалищната флора от Дьодерлайн през 1892 г. до днес този факт остава непроменен. В негова чест, влагалищните лактобацили са наречени Дьодерлайнови бактерии. Общото свойство на тези Грам положителни бактерии е способността им да ферментират въглехидратите до млечна киселина, откъдето е тяхното име млечно-кисели бактерии. Лактобацилите са най голямата група млечно-кисели бактерии. От особено значение е поддържането на микробното равновесие във влагалището за предпазване от асцендиране на патогени. Микробното вагинално равновесие се определя от лактобацилите, които продуцират млечна киселина, водороден прекис, биосърфактанти, бактериоцини, конкурират патогените за адхезия към влагалищните епителни клетки, модулират локалният имунен отговор и системата на плазмин-плазминогенът. Чрез тези механизми те блокират растежа и развитието на останалите влагалищни микробни видове, както и на видовете внесени отвън. Затова, те могат да бъдат използвани като профилактични и терапевтични средства.
Широкото внедряване в акушеро-гинекологичната практика на препарати съдържащи живи лактобацили, започна след 2000 г. „Пробиотици” е официално приетият термин за тези препарати. Пробиотиците са живи микроорганизми, които внесени в адекватни количества имат здравословно влияние вьрху гостоприемникa. Тази дефиниция точно определя използването на думата пробиотик само за продукти, съдържащи живи микроорганизми и също така определя изискването от адекватна доза пробиотични бактерии за постигане на очакван ефект.
https://deusspharm.bg/product/womens-daily-probiotic-%d0%bf%d1%80%d0%be%d0%b1%d0%b8%d0%be%d1%82%d0%b8%d0%ba-%d0%b7%d0%b0-%d0%b6%d0%b5%d0%bd%d0%b8-25-%d0%bc%d0%bb%d1%80%d0%b4-%d0%b0%d0%ba%d1%82%d0%b8%d0%b2%d0%bd%d0%b8/
https://deusspharm.bg/product/%d0%b4%d0%b0%d0%bc%d1%81%d0%ba%d0%b8-%d0%bf%d1%80%d0%be%d0%b1%d0%b8%d0%be%d1%82%d0%b8%d0%ba-%d0%b7%d0%b0-%d0%b7%d0%b4%d1%80%d0%b0%d0%b2%d0%b5%d1%82%d0%be-%d0%bd%d0%b0-%d0%b8%d0%bd%d1%82%d0%b8%d0%bc/









